Ист. http://registrel.livejournal.com/742.html
_______________________
Уважаемый Дмитрий Анатольевич,
мы обращаемся к Вам с надеждой быть услышанными, даже несмотря на нашу малочисленность. Мы группа специалистов, провизоров и врачей, работающих как в отечественных, так и в зарубежных фармацевтических компаниях. В наши должностные обязанности входит подготовка всей необходимой документации и доказательной базы для государственной регистрации лекарственных препаратов, производимых нашими компаниями-работодателями, а так же взаимодействие с государственными органами, выполняющими функцию по регистрации лекарственных препаратов.
Но мы обращаемся к вам не как представители фармацевтической индустрии, а как граждане России, которые тоже болеют и лечатся этими же лекарствами. В ходе исполнения своих профессиональных обязанностей и исходя из своих знаний и опыта мы первыми столкнулись с назревающей угрозой для отечественного здравоохранения и считаем обязанными предупредить Вас о ней.
Несомненно, Вы помните в какой спешке и при мощнейшем лоббировании Минздравсоцразвития в апреле прошлого года принимался в государственной думе Закон «Об обращении лекарственных средств». К сожалению, критические отзывы фармацевтической и медицинской общественности были представлены как лоббирование интересов фармацевтического бизнеса, поэтому были проигнорированы.
Со своей стороны, как простые граждане, не являющиеся собственниками и выгодоприобретателями фармацевтических производств, хотим Вас уверить, что та критика, иногда звучавшая даже с надрывом и на грани отчаяния, являлась искренней, конструктивной и оправданной и происходила не из соображений выгоды для фармацевтической индустрии. Принятый закон на самом деле является даже не столько коррупционным, хотя совсем в этом ему отказать нельзя, сколько банально безграмотным и непрофессиональным. Разрешите сейчас не повторяться и подробно не объяснять все казусы принятого закона. Год назад уже были подготовлены и отправлены в десятки инстанций многочисленные поправки и комментарии к нему, в том числе и с подробной аргументацией данного тезиса.
Позволим себе сейчас обратить Ваше внимание лишь на одну, как нам кажется, очень показательную и, к сожалению, опасную глупость. Так, согласно процедуре установленной законом «Об обращении лекарственных средств», проверка качества нового лекарственного препарата в лаборатории производится уже после того, как препарат испытают на живых людях! Любой специалист, работающий в нашей области и хоть немного знакомый с международными подходами к регистрации лекарств и здравым смыслом, укажет еще на десятки пунктов, показывающих полное непонимание составителями закона специфики регулируемой ими отрасли.
Теперь же остановимся на том, что принятый закон просто физически неисполним, и никакие даже чрезвычайные усилия, предпринимаемые Министерством здравоохранения и социального развития не будут эффективны. Сейчас, несмотря на героический режим работы рядовых сотрудников Минздрава и подведомственной ему экспертной организации ФГБУ «Научный центр экспертизы средств медицинского применения», остающихся работать после окончания рабочего дня, работающих в субботу и в воскресенье, в Минздраве скопились тысячи необработанных дел, а это значит, что множество необходимых препаратов не могут выйти на российский рынок.
Это лукавство со стороны Минздрава объяснять нынешние, мягко говоря, «сложности» переходным периодом. Напомним, что закон был подписан 12 апреля 2010 года и вступил в силу только с 01 сентября 2010. Таким образом, у министерства было более четырех месяцев, чтобы продумать все сложности переходного периода и подготовится к ним, заготовить для себя и отрасли ответы на наиболее сложные и спорные вопросы. Фактически же работа по подготовке к работе по новому закону началась только 1 сентября 2010 года. Только с этого момента сотрудники Минздрава, погрузившись в работу и начиная осознавать глубину навалившихся проблем, о которых их предупреждали еще при разработке закона, начали инициировать одну за другой поправки в только что принятый закон. В настоящее время закон имеет уже три поправки (от 27.07.2010, 11.10.2010 и от 29.11.2010).
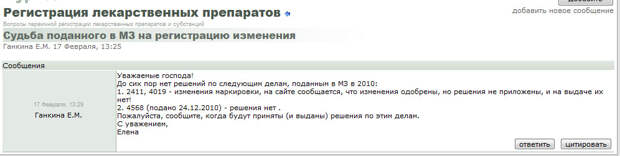
Этими поправками Минздрав установил «переходный период», закончившийся 1 марта 2011 года. Именно до этого времени, начиная с 29.11.2010, то есть всего за три месяца, подведомственная организация Минздравсоцразвития ФГБУ «НЦ ЭСМП» должна была закончить в авральном порядке ранее начатую экспертизу всех препаратов, находившихся в работе, а это более 7000 дел. В результате экспертиза огромного числа лекарственных препаратов была проведена формально. Совершенно понятно, что за столь короткий период невозможно было качественно провести экспертизу такого количества препаратов. По большинству препаратов производителями были получены неполные или отрицательные экспертные заключения с формальными замечаниями по оформлению документации. Наличие же замечаний в экспертном отчете означает затягивание процесса выхода препарата на рынок еще на срок от 6-7 месяцев до года и более.
Именно эти дела стремились сначала получить из ФГБУ «НЦ ЭСМП», а потом успеть сдать до 1 марта в Минздравсоцразвития представители фармацевтических компаний, запечатленные на этом видео.
На стр.
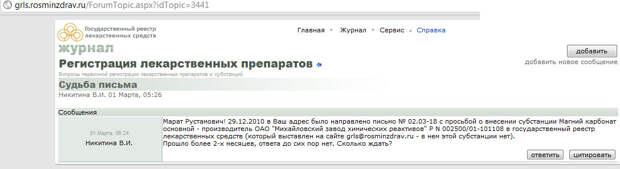
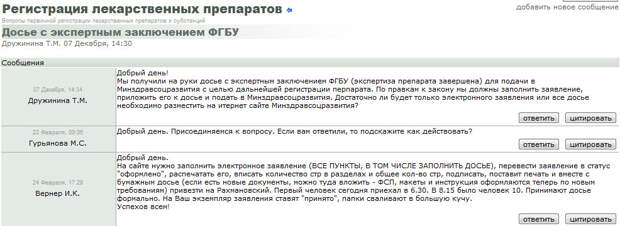
Форум доступен только по предварительной регистрации, но ниже мы приведем несколько скриншотов с него.
В последнее время, не имея возможности в установленный срок выполнить требования закона, Минздрав начал откровенно подтасовывать данные на портале grls.rosminzdrav.ru. Так, данные о том, что регистрационные удостоверения выданы, появляются вовремя. При этом фактически документы еще только готовятся и фармацевтические компании не могут их получить. Обсуждение этого недавно выявленного факта можно почитать на нашем профессиональном форуме представителей фармацевтических компаний
Следующей и, на наш взгляд, ключевой проблемой, с которой еще только столкнется Минздрав – это проблема полного закрытия обратной связи экспертной организации и фармацевтической компании. Это означает, что при нахождении замечаний к представленным компанией документам или возникновении каких-либо сомнений относительно их содержания, эксперт в соответствии с новым законом не имеет фактической возможности написать письмо с вопросом разработчику лекарственного препарата. Предыдущая практика работы с экспертной организацией в рамках старого законодательства показывает, что по подавляющему числу препаратов такие вопросы возникают и не однократно. И связано это прежде всего не с неспособностью сотрудников фармацевтических компаний правильно подготовить препарат к регистрации, а с полным отсутствием подзаконных нормативных актов (количество которых, для сравнения, в развитых странах исчисляется сотнями и тысячами), детально и четко описывающих правила составления документации, выбора и объема необходимых исследований.
Таким образом, без предварительной разработки и внедрения четких и понятных правил и требований, практически все препараты должны будут получать отказ в регистрации из-за выявленных в ходе экспертизы несоответствий, зачастую носящих крайне формальный, редакционный характер, например, исправить падеж в описании метода контроля качества или изменить последовательность разделов. Раньше все эти проблемы решались за счет переписки экспертной организации с разработчиком лекарственного препарата. Неизбежные многочисленные отказы в регистрации и необходимость повторной, зачастую многократной подачи препарата на государственную регистрацию до полного устранения всех замечаний вызовет существенное удорожание и затягивание процесса регистрации, что в свою очередь отрицательно скажется на доступности лекарств для населения.
Дмитрий Анатольевич, в завершение, зная по многочисленным сообщениям СМИ Ваше негативное отношение к «клановости и семейственности», хотим также обратить внимание на то, что такая система начинает складываться и в этой сфере. Так, например, заместитель директора ФГБУ «НЦ ЭСМП» Сакаева Ирина Вячеславовна является женой руководителя департамента государственного регулирования обращения лекарственных средств Минздравсоцразвития Сакаева Марата Рустамовича, в чьем ведении и находится регистрация лекарственных препаратов. Директором же ФГБУ «НЦ ЭСМП» назначен до недавнего времени коллега И.В. Сакаевой по фармацевтической компании Микроген – Миронов Александр Николаевич.
Господин Президент, мы надеемся, что Вы проверите изложенные в нашем обращении факты и примите соответствующие меры по исправлению сложившейся ситуации и предотвращению ее эскалации до масштабов страны.
С уважением и надеждой, граждане России регистраторы лекарственных препаратов.


Свежие комментарии